Az alábbi cikket 2004-ben írtam 11-ikes gimnazistaként az athéni olimpiára.
Az athéni olimpia
A világ számos részéről gyülekeznek a sportolók Athénban, hogy részt vegyenek a sport legnagyobb ünnepén. Céljuk fényes, dicsőséges. Aranyéremnek hívják. Nem adják ingyen. Érte keményen meg kell dolgozni, de emellett rendelkeznie kell a versenyzőnek a megfelelő adottságokkal. Az út az aranyig fáradalmas, melyet sokan megrövidítenének vagy azért, mert hajlandóak bevállalni az esetleges mellékhatásokat, vagy azért, hogy lépést tartsanak a hasonlóan cselekvő riválisokkal. A visszatérő doppingbotrányok ellenére sok atléta számára ellenállhatatlan kísértés szteroidokhoz nyúlni. Ahol a győzelem és nem a részvétel az elsődleges, az atléták megragadnának minden lehetőséget, hogy megszerezzék azt a néhány századmásodpercnyi sebességet, vagy egy kis lökést az állóképességnek.
A sporthatóságok tartanak attól, hogy egy újfajta kimutathatatlan doppingmódszer van készülőben. Új kezelési eljárások, melyek regenerálják az izmot, növelik erejét és megvédik az elsorvadástól, hamarosan emberkísérleti stádiumba kerülnek. Ezeket izomsorvadásos betegségek kezelésére fejlesztették ki. Ezek között az eljárások között vannak olyanok, melyek a betegbe egy szintetikus gént adnak be, mely több évig kifejti hatását, és nagy mennyiségű, természetesen előforduló izomépítő vegyületeket hoz létre. Ez a fajta génterápia megváltoztathatja az idősek, valamint az izom dystrophiában szenvedők életét. Ezen gyógyító hatásai mellett, a doppingra hajló sportolók számára ez egy megvalósult álom. A keletkezett vegyületek megkülönböztethetetlenek a természetes eredetű megfelelőiktől, valamint általában helyben, az izomszövetben termelődnek. Semmi sem kerül a véráramba, ezért nincs mit a hatóságoknak kimutatniuk a vér- vagy vizeletmintában. A Nemzetközi Doppingellenes Ügynökség (WADA) felkért több tudóst, hogy dolgozzanak ki eljárásokat, melyekkel meg lehet akadályozni, hogy a génterápia a dopping új formája legyen. Ahogy ezek az eljárások bekerülnek a klinikai gyakorlatba, és elterjednek, lehetetlenné válik megakadályozni, hogy a sportolók ne férjenek hozzá.

World Anti-Dopping Agency (WADA)
Vajon a génterápia a sportcsalás új high-tech módja lesz?
Vajon a gyógyító célú génterápia annyira elterjed, hogy a teljesítménynövelés céljából tett génmanipulációt általánosan elfogadják? Minden bizonnyal a mostani egyike az utolsó olimpiáknak, melyen génkezeletlen atléták vesznek részt.
A genetikai úton történő izomméret – és erőnövelő kutatások nem elsősorban az élsportolót célozták meg. Az életszínvonal növekedése miatt növekszik a várható élettartam. Egyre többen élnek akár 80-90 évet is (a helyi TB vágyai ellenére). Mind az izomerő, mind az izomtömeg 30 és 80 éves kor között akár harmadával is csökkenhet. Három féle izom létezik: a simaizom, mely akaratlanul végzi a dolgát (pl. gyomor összehúzódás); a szívizom; valamint a vázizom, ez adja a mozgáshoz szükséges erőt és az idő során ez sorvad el leginkább. Ha csökken az izomerő, az egyensúly elvesztése valószínűbb és kisebb rá az esély, hogy ezt időben korrigálja. Ha egyszer egy esés combnyaktörést okoz, oda a mozgékonyság. Idővel minden emlősben csökken a vázizom, melyet valószínűleg a normál használat által okozott sérülések helyrehozásának halmozott nehézsége okoz. Az izomsorvadás legelterjedtebb és legsúlyosabb típusa a Duchenne izomdystrophia. Ebben a használat általi károsodás ütemével nem tudnak lépést tartani az izom regeneratív mechanizmusai. Mind ebben, mind az időskori izomcsökkenés esetében az izomszövet elhal és helyét kötő- és zsírszövet tölti ki. Ezzel ellentétben az űrhajósoknál és a mozgásképtelen betegeknél tapasztalható súlyos vázizom csökkenés az izom javító és növesztő mechanizmusainak a teljes leállása, valamint az egyidejű apoptosis, a sejtek előre beprogramozott elhalása felgyorsul. Ezt a jelenséget még nem teljesen értjük, de azt tudjuk, hogy evolúciós szempontból a vázizom fenntartása költséges, ezért célszerű szoros kapcsolatot tartani az izomméret -és használat között. Ezzel ellentétben használat során növekszik az izom.
Az izomrostok kollektív összehúzódása következtében megfeszül az izom és erőt fejt ki, de ha ezt az erőt nem tudja elvezetni, akkor kárt okoz az izomszövetben.
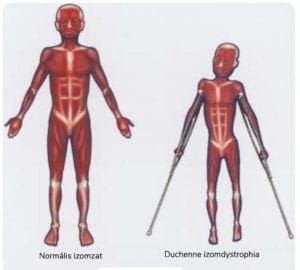
Duchenne izomdystrophia
A Duchenne izomdystrophiás betegeknél a dystrophin nevű fehérje hiányzik, mely megvédi az izomrostot. Ennek ellenére a normál használat sérüléseket okoz az izomrostokban. Ez valójában egy módja lehet annak, hogy hogyan növeli az edzés az izomtömeget. A rostokban keletkező mikrorepedések következtében aktiválódnak az izmot regeneráló mechanizmusok, növelve annak méretét, hogy megfeleljen a követelményeknek. Ezt a folyamatot mind növekedésserkentő, mind gátló faktorok szabályozzák. Ilyen növekedési faktor az I vagy az IGF-I, illetve gátló faktor a myostatin. Ha az IGF-I proteint közvetlenül az izomba fecskendeznénk, a fehérje órák alatt elhalna. Ha viszont egy gént viszünk be egy sejtbe, akkor az a sejt élete végéig funkcionál.

Duchenne izomdystrophia
A génterápia sikeres alkalmazásának legnagyobb gátja, hogy hogyan juttassuk el a választott gént a megfelelő szövetbe. Erre a célra leginkább valamilyen ártalmatlan vírust, ún. vektort alkalmaznak, mely behatol a sejtbe, mint egy biológiai trójai faló, és ott fejti ki hatását. Génterapeuták ezt a tulajdonságot használják ki. Egy szintetikus gént csatolnak hozzá a vírushoz, valamint eltávolítják azokat a géneket, melyeket a vírus felhasznál, hogy másolja önmagát, vagy hogy fertőzést okozzon. Erre alkalmas vírus az adeno asszociált vírus (AAV), amely eleve jelen van egyesek izmaiban, de semmilyen ismert betegséget nem vált ki. A kísérletek úgy kezdődtek, hogy ezt módosították egy szintetikus génnel, mely csak a vázizomban termelne IGF-I-t. Ezt egérkísérletek alá vetettük. Az izomméret és annak növekedési üteme 15-30%-kal haladta meg a normálist, emellett amikor ugyanezt a kísérletet középkorú egereken végezték el és utána hagyták őket öregedni, az izmaik ereje nem halványult. A biztonságot szem előtt tartva végeztek egy olyan kísérletet, melyben az egereket úgy génkezelték, hogy az IGF-I-t az egész vázizomban túltermeljék. A normál egerekhez képest 20-50%-kal növekedett a vázizmuk, valamint megőrizték regeneratív képességüket, mely a fiatalabb egyedekre jellemző. Legalább olyan fontos, hogy az IGF-I szintjük csak az izmokban növekedett meg és nem a véráramban. Az ott megnövekedett IGF-I szint növelte volna a szívproblémák és a rák kialakulásának veszélyét. Az egerekben több kísérlet kimutatta, hogy az IGF-I túltermelés elősegíti az izomjavítást még a súlyos izomsorvadásos egerekben is.

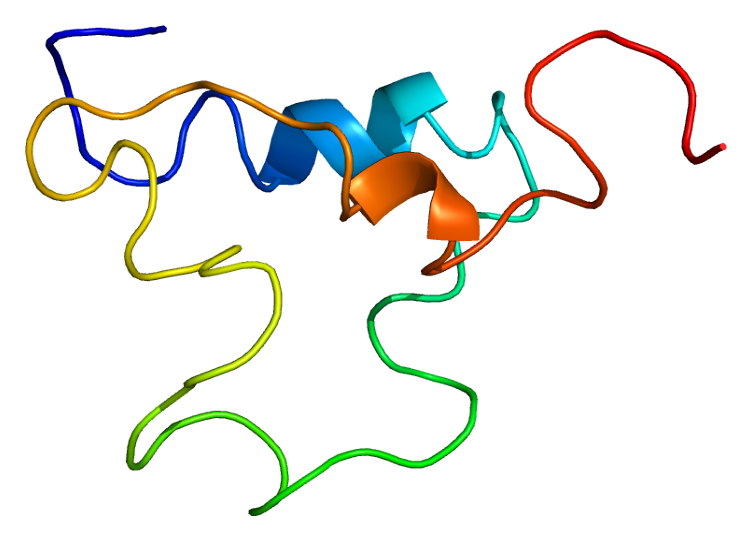
IGF-I protein
Az izomnövekedés mértéke arra utal, hogy ezt az eljárást alkalmazni lehet az egyébként egészséges izmokban is. Néhány egérnél csak az egyik lábat kezelték és utána egy nyolchetes súlyemelő kúrára küldték. Ugyanazon állat kezelt lábai majdnem kétszer olyan erősek lettek, mint a kezeletlenek és lassabban vesztették el erejüket. A kísérletek jelenleg kutyákkal folynak. Az IGF-I, mint minden növekedési faktor, növeli a tumorok kialakulásának veszélyét. A biztonság miatt, valamint az olyan kérdések, mint pl. az AAV-t az emberben jobb a véráramba, vagy közvetlen befecskendezéssel az izomszövetbe juttatni, ez a kezelési eljárás még legalább egy évtizedig várat magára.
Természetes mutációk
A másik eljárás ötletét a természet adta. Ez a myostatin blokkolása. A myostatin gátolja az izomnövekedést. A piedmonti és a belga kék marha olyan öröklött genetikai mutációval rendelkeznek, melyeknél a myostatin hatástalan változata szerepel. Ezeket a marhákat duplaizmúnak szokták nevezni. A myostatin hiánya emellett megzavarja a zsírlerakódást, amely kiváltképp sovány húst eredményez.

Hibás myostatin hatása
Az első myostatin blokkoló gyógyszerek, a myostatin elleni antitestek, közülük egyet nemsokára klinikai tesztek alá fognak vetni. Egy másik megközelítés utánozza a marhák mutációját, mely a myostatin egy kisebb verzióját termeli, amely nem rendelkezik a normális molekula jelzőképességével, viszont ugyanúgy kapcsolódik az érzékelő sejtekhez. Ez a kisebb fehérje elzárja a kapcsolódási helyeket, így a rendes méretű myostatin nem közvetíti a kémiai ingert.
Bár a gyógyszerkezeléssel nem lehet kijelölt izmokat célba venni, a hatóságok könnyebben ki tudják őket mutatni egy vérvétellel, de előnyük, hogy bármikor abba lehet őket hagyni, ha valami probléma fennáll. Ezeket eredetileg különböző izomsorvadásos betegségek ellen fejlesztették ki, úgymint az említett génterápiákat, bár ma még vagy kísérleti vagy tesztelési stádiumban vannak. Ha elterjednek a klinikai gyakorlatban, kiváltképp a génterápiai megoldás, lehetetlen lesz megakadályozni, hogy jogosulatlan személyek ne férjenek hozzá. Egy izomszövetről csak úgy lehet eldönteni, hogy alávetették-e génkezelésnek, ha magából az izomból vesznek mintát. Ezt persze kevés sportoló vállalná egy nagy megmérettetés előtt.
Vajon egy hirtelen 20-40%-kal növelt izomtömegű sportoló ki tudna-e fejteni annyi erőt, hogy eltörje vagy elszakítsa saját csontját vagy ínjait? Valószínűleg nem. Inkább azzal törődünk, hogy hogyan lehet az öregek izmait megerősíteni, akiknek csontjait kikezdte a csontritkulás. Egy fiatal, egészséges ember számára egy több hét vagy hónap alatt lezajló izomnövekedés elegendő időt ad, hogy a támasztóelemek közben kellően megerősödjenek.

Lance Armstrong EPO használat miatt veszttete a Tour de France győztes címeit
Valószínűleg az izomszövet lesz először a génterápia célpontja. Utána másokat is meg lehet célozni. Igénytől függően meg lehet változtatni az izom típusát vagy az állóképességet a megnövekedett oxigénfelvétellel. Az erythropoietin egy természetes fehérje, mely növeli az oxigénszállító vörösvérsejtek számát. Mesterséges formája az epoietin (EPO), melyet vérszegénység kezelésére fejlesztettek ki. Az 1998-as Tour de France-on egy egész csapatot zártak ki az EPO használatáért. Az erythropoietin génkezelés általi növelését már állatokon tesztelték. 1997-ben és 1998-ban tudósok egy csoportja majmokba és páviánokba szintetikus erythropoietin géneket vitt át. Mindkét kísérletben az állatok vörösvérsejtszáma 10 hét alatt majdnem megduplázódott. A vérük olyan sűrű lett, hogy rendszeresen hígítani kellett, hogy ne kapjanak szívbénulást. Az eredmények jól mutatják, milyen hatással lehetnek az ilyen beavatkozások, ha idő előtt emberen végzik.
Géntechnológia dopping célú felhasználásának etikai kérdései
A biztonsági kérdések mellett etikaiak is felmerülnek. A kutatások során több embert is azonosítottak, akiknek valamilyen genetikai mutáció miatt megnövekedett a fizikai teljesítőképességük. Az egyik ilyen személy, akiben a myostatin termelés nagyon alacsony, családjában állítólag egy európabajnok súlyemelő is található. A finn Eero Mäntyranta-ban , aki két aranyérmet is nyert az 1964-es téli olimpián sífutásból, évekkel később egy olyan génmutációt azonosítottak, mely ő és családja számára a normálisnál nagyobb vörösvérsejtszámot biztosított, amely meghaladta az EPO-val lehetségest is.

Eero Mäntyranta
A mai napig több mint 90 olyan gént azonosítottak, mely összefügg a fizikai teljesítménnyel. Olyan etikai kérdések merülnek fel a biztonság mellett, hogy vajon nem fogják-e aszerint megkülönböztetni a gyerekeket, hogy milyen a genetikai állományuk, amikor különböző sportágakba válogatják őket. Vajon a természetes mutációkkal rendelkező sportolók nem rendelkeznek egy igazságtalan versenyelőnnyel? Személyes véleményem szerint ez inkább „Isten ajándéka”. Vajon ez feljogosítja-e a többi résztvevőt, hogy ők „fogyatékosságaikat” mesterségesen kiküszöböljék? A géndopping lehetősége még legalább egy évtizednyire van. Talán ez az idő elégséges arra, hogy az ilyen kérdésekre választ adjunk, mielőtt alkalmazni tudnánk ezeket az eljárásokat. Még a jelenlegi kísérleti stádiumban is tisztán látható, hogy gyógyítási, vagy esetleg egyéb célra ezek az eljárások hatalmas potenciállal rendelkeznek. Csak nem szabad megfeledkezni arról, hogy minden tényezőt számításba kell venni, még ha nagyon sok is van belőle. Az atomenergiához hasonlóan, ha már egyszer kiengedtük a szellemet a palackból, akkor nem fogjuk tudni oda visszagyömöszölni.